El uso del ensayo por inmunoabsorción ligado a enzimas (ELISA, por sus siglas en inglés) para la detección de proteínas (antígenos o anticuerpos) es una de las herramientas más fácilmente disponibles en todo el mundo y actualmente se usa mucho en la producción porcina. El test se usa comúnmente en la vigilancia y el seguimiento de enfermedades, así como herramienta diagnóstica. Ya que los veterinarios porcinos la utilizan a menudo, es básico comprender cómo funciona, qué detecta y sus ventajas o desventajas al interpretar los resultados. También es importante recordar que, aunque se usa la misma tecnología frente a diferentes patógenos, los resultados deben interpretarse de modos distintos.
Información del test
Los test ELISA se diseñan para la detección de antígenos o anticuerpos frente a bacterias o virus. Los antígenos son proteínas extrañas para el organismo que estimulan la producción de anticuerpos (en inglés significa "generador de anticuerpos": antigen = antibody generator). Al pensar en anticuerpos, debemos tener en cuenta que siempre son contra proteínas. Al diseñar el ensayo, el fabricante o laboratorio, decide qué proteína específica, o proteínas, serán el objetivo. Si el ELISA se dirige directamente a una proteína situada sobre la bacteria o virus, se denomina ELISA de antígenos, mientras que, si el objetivo es la respuesta de anticuerpos del animal frente a la bacteria o virus, se conoce como ELISA de anticuerpos. Aunque existen ensayos de ELISA diseñados para dirigirse únicamente a una o dos proteínas (anticuerpos o antígenos), muchos se dirigen a un gran número de proteínas. Los ensayos también se pueden diseñar para detectar un tipo específico de respuesta de anticuerpos (IgG, IgM o IgA) o una combinación de ellas. Cada uno de estos tipos de anticuerpos tiene funciones específicas que están fuera del objetivo de este artículo.

El concepto y el proceso para la detección de anticuerpos o antígenos mediante ELISA es exactamente el mismo. Empieza obteniendo la proteína objetivo (antígeno o anticuerpo). Para proteínas individuales, se necesita un proceso separado para obtener una concentración purificada de esta proteína concreta. Identificar a qué proteína o proteínas dirigirnos es un proceso científico y complejo. Idealmente, el ensayo se dirige a una única proteína que es exclusiva del patógeno de interés (no tiene reacciones cruzadas con otros patógenos), muy inmunogénica (para la detección de anticuerpos) o se encuentra en concentraciones elevadas (para la detección de antígenos); se dirige a una proteína que se sabe que está muy correlacionada con la protección contra la enfermedad y siempre estará presente. Por desgracia, la mayoría de estos criterios son desconocidos y se usa una proteína única, que puede ser producida y encontrada con facilidad en la muestra, o una mezcla de múltiples proteínas (virus o bacterias enteras). Aunque el uso de virus o bacterias enteras pueda ser fácil, es más probable que produzcan reacciones cruzadas con otros patógenos.
Pasos generales del proceso (ver figura 1).
- Paso 1. Se recubren previamente los micropocillos con los antígeno(s) objetivo (para detectar anticuerpos) o anticuerpos (para detectar antígenos).
- Paso 2. Se añaden las muestras a analizar e incubar para permitir la unión entre los antígenos y los anticuerpos.
- Paso 3. Se retira la muestra y se añaden los anticuerpos especiales que se adherirán al lado opuesto de los anticuerpos (parte inferior de la “Y” del anticuerpo en la detección de anticuerpos) o de los antígenos (parte superior de la “Y” en la detección de antígenos). Entonces se incuba la muestra para permitir la unión y se lava para asegurarnos de que se eliminan los anticuerpos o antígenos que no se hayan adherido (es decir, los no objetivo).
- Paso 4. Se añade el anticuerpo que está marcado con un detector que emite fluorescencia y se adherirá a los anticuerpos especiales del paso 3 (se adhieren a la parte inferior de la “Y” del anticuerpo; es el mismo objetivo tanto para la detección de antígenos o de anticuerpos). En ese momento la muestra se incuba de nuevo para permitir la unión y se vuelve a lavar para asegurarnos de eliminar los anticuerpos marcados que no se hayan adherido.
- Paso 5. Se añade el reactivo que desencadenará la fluorescencia de los anticuerpos marcados que se hayan adherido y luego se incuba para asegurar la unión.
- Paso 6. Se lee la muestra, normalmente usando una máquina especial calibrada a una longitud de onda específica para cuantificar el cambio de color (referido como absorbancia). Hay algunas ligeras variaciones en este proceso dependiendo de si es un ELISA directo, indirecto o sándwich; cada tipo tiene sus ventajas y desventajas (que no exponemos aquí) pero, al final, todas obtienen los mismos resultados; cuanto mayor sea la absorbancia, o cambio de color, mayor será la concentración esperada del antígeno o anticuerpo objetivo en la muestra analizada.
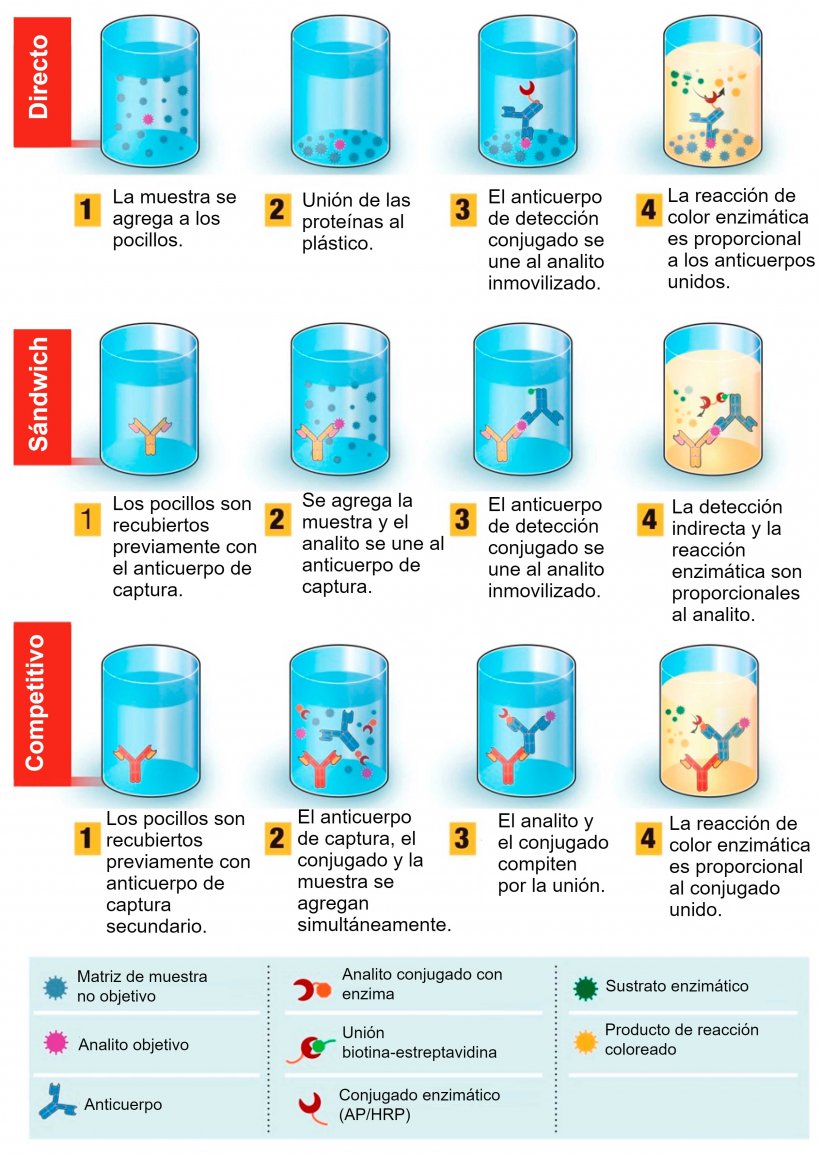
Figura 1. Descripción general de la prueba de diagnóstico basada en el ensayo por inmunoabsorción ligado a enzimas (ELISA). ELISA se puede presentar en diferentes formatos en función de las diferencias en la inmovilización de los antígenos y el marcado de los anticuerpos. En el ELISA directo, los antígenos del virus unidos a una fase sólida plástica se detectan mediante la adición de un anticuerpo conjugado. En el ELISA sándwich, el anticuerpo de captura se une a la fase sólida plástica. Los antígenos de la muestra se unirán al anticuerpo de captura y luego serán detectados por un segundo anticuerpo marcado con enzima. En el ELISA competitivo, el antígeno del virus de la muestra se preincuba con el anticuerpo primario y luego se agrega a un pocillo cubierto con un anticuerpo secundario junto con un antígeno conjugado con enzima que compite con el antígeno de la muestra para unirse al anticuerpo primario. Cuanto más antígeno viral haya en la muestra, menos antígeno conjugado se unirá y menor será la señal. Fuente: Adaptado de Ghaffari et al. 2020.
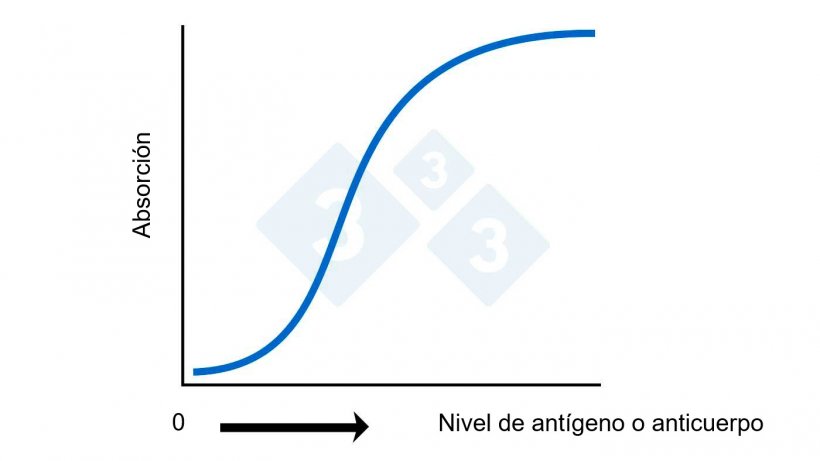
Figura 2A. ELISA: Cálculo del nivel de antígeno o anticuerpo basado en la absorción.
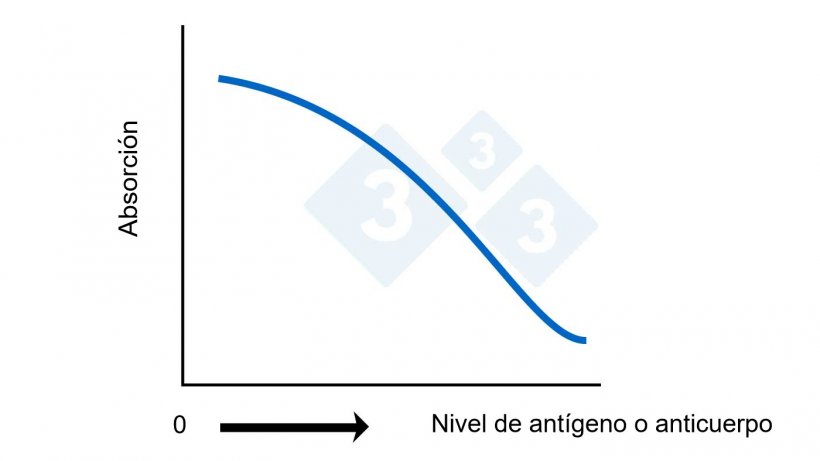
Figura 2B. ELISA competitivo. Cálculo del nivel de antígeno o anticuerpo basado en la absorción.
El punto de corte para cada test ELISA puede ser diferente y viene preestablecido por el fabricante en base a la sensibilidad y especificidad deseadas. Para los ELISAs directos, indirectos o sándwich, cualquier número superior al punto de corte se considera positivo. Para un ELISA competitivo, cualquier número superior al punto de corte se considera negativo. En algunos test se establece una zona gris para clasificar las muestras como “sospechosas” ya que el test tiende a tener algunas reacciones “de fondo” (reacciones cruzadas) que dificultan tener un punto de corte claro.
Los resultados se suelen mostrar, aunque no siempre, como una S:P corregida o porcentaje de positividad con respecto al control positivo corregida según el cambio de color del fondo de los pocillos control negativos. A menudo, los niveles de anticuerpos se denominan "títulos". Aunque no es técnicamente correcto, se puede justificar en una perspectiva general. Un punto clave es que cuando se habla de títulos hay una relación matemática directa entre los valores (un valor de 20 tiene el doble de anticuerpos que una muestra con un valor de 10). Con los valores de ELISA, esta relación matemática directa no existe (ver figura 2A). Un ELISA de 2,0 tiene significativamente más anticuerpos que una de 1,0 y no sólo el doble.
Agrupación de muestras para el análisis
Debido a que los test ELISA dependen de la concentración (se correlacionan directamente con la concentración de la proteína objetivo [anticuerpo o antígeno]) se desaconseja encarecidamente la agrupación de muestras. Al agruparlas puede aumentar significativamente la probabilidad de perdernos una muestra positiva.
Algunos usos de ELISA:
- Detectar la presencia de anticuerpos frente a patógenos específicos – ELISA de anticuerpos – Es el uso más común.
- Determinar la exposición a un patógeno.
- Determinar el estado vacunal de un animal.
- Determinar el momento de la infección (cambio del nivel de anticuerpos) a lo largo del tiempo.
- Detectar la presencia de un patógeno objetivo a través de la detección de proteínas/antígenos del patógeno objetivo – ELISA de antígenos.




